第一類醫療器械備案辦理服務介紹
我們為境外醫療器械生產、經營、流通和貿易企業提供全方位、一站式的醫療器械進口備案辦理服務:
一.
第一類醫療器械備案法規依據:
1. 《醫療器械監督管理條例》(國務院令第739號)
2. 《醫療器械注冊與備案管理辦法》(市場總局局令第47號)
3. 《關于第一類醫療器械備案有關事項的公告》(第26號)
4. 《關于發布第一類醫療器械產品目錄的通告》(2021年第158號)
5. 《關于實施第一類醫療器械備案有關事項的通知》(食藥監辦械管[2014] 174號)
其中主要法規依據如下:
(1)根據《醫療器械監督管理條例》第十三條: 第一類醫療器械實行產品備案管理,第二類、第三類醫療器械實行產品注冊管理。
醫療器械注冊人、備案人應當加強醫療器械全生命周期質量管理,對研制、生產、經營、使用全過程中醫療器械的安全性、有效性依法承擔責任。
(2)根據《醫療器械注冊與備案管理辦法》第三條: 醫療器械注冊是指醫療器械注冊申請人(以下簡稱申請人)依照法定程序和要求提出醫療器械注冊申請,藥品監督管理部門依據法律法規,基于科學認知,進行安全性、有效性和質量可控性等審查,決定是否同意其申請的活動。
醫療器械備案是指醫療器械備案人(以下簡稱備案人)依照法定程序和要求向藥品監督管理部門提交備案資料,藥品監督管理部門對提交的備案資料存檔備查的活動
(3)根據《醫療器械注冊與備案管理辦法》第八條: 第一類醫療器械實行產品備案管理。第二類、第三類醫療器械實行產品注冊管理
(4)境內第一類醫療器械備案,備案人向設區的市級負責藥品監督管理的部門提交備案資料。
(5)境內第二類醫療器械由省、自治區、直轄市藥品監督管理部門審查,批準后發給醫療器械注冊證。
(6)境內第三類醫療器械由國家藥品監督管理局審查,批準后發給醫療器械注冊證。
(7)進口第一類醫療器械備案,備案人向國家藥品監督管理局提交備案資料。
(8)進口第二類、第三類醫療器械由國家藥品監督管理局審查,批準后發給醫療器械注冊證。
二、第一類醫療器械產品備案所需基本資料:
(一)產品風險分析資料;
(二)產品技術要求;
(三)產品檢驗報告;
(四)臨床評價資料;
(五)產品說明書以及標簽樣稿;
(六)與產品研制、生產有關的質量管理體系文件;
(七)證明產品安全、有效所需的其他資料。
產品檢驗報告應當符合國務院藥品監督管理部門的要求,可以是醫療器械注冊申請人、備案人的自檢報告,也可以是委托有資質的醫療器械檢驗機構出具的檢驗報告。
符合《醫療器械監督管理條例》第二十四條規定的免于進行臨床評價情形的,可以免于提交臨床評價資料。
醫療器械注冊申請人、備案人應當確保提交的資料合法、真實、準確、完整和可追溯。
三、
第一類醫療器械備案辦理服務
1.評估確認產品分類依據
2.撰寫產品風險分析資料;
3.撰寫產品技術要求;
4.協助辦理產品檢驗報告;
5.協助撰寫臨床評價資料;
6.協助編寫產品說明書以及標簽樣稿;
7.與產品研制、生產有關的質量管理體系文件建立服務;
8.證明產品安全、有效所需的其他資料編寫;
9.廠房選址、設備選型與配置指導;
10.建立符合醫療器械法規的質量管理體系;
11.進口醫療器械備案辦理服務;
12.醫療器械備案升級醫療器械注冊延伸服務;
13.其他定制化醫療器械服務。
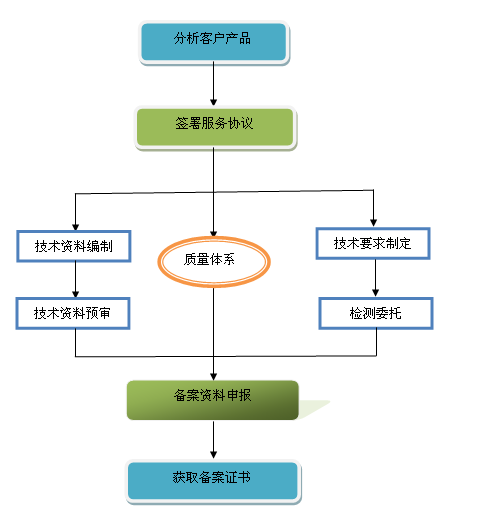
服務流程圖: